-
Piégez des saveurs dans des perles gélifiées
Science Piégez des saveurs dans des perles gélifiées 
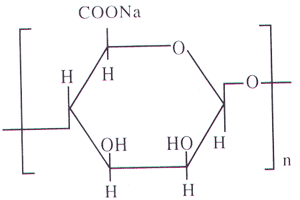
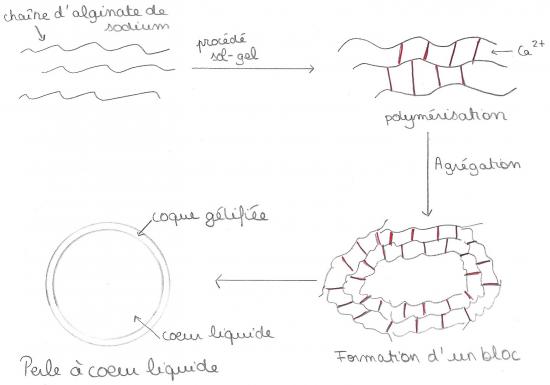
 suivre Forum  Tags : alginate, calcium, sodium, bain, eau
Tags : alginate, calcium, sodium, bain, eau
-
Commentaires
Blog & Forum de Jouy sous Thelle
- Forum Jardin
- 4253 articles
- Dernier article
- Jules Hostouley
- Marmandin
- Blog d'un jardin Blanc
- Mes Science & vie
- 100 ans d'aviation
- Collection d'éléphants
- La Maison de Titine
- Annuaire Jardin Blanc
- Le diable en rit encore
- Un Ch'ti Jardinier
- Fiches Tomates
- Conseil Municipal
- Brocantes
- Météo
- Les champignons
- Apiculture
-
Nos blogs....
-
Fassebook
-
Sondage
-
Actualité
-
Rubriques
-
Calendrier... Chargement ...
L M M J V S D -
Commentaires
- Arnaud : Ca peut arriver à n'importe quelle boîte. Cette firme...
- mimine : Brocante sympa jaime
- mimine : Pas chaud
- Achille : Cultivé cette variété en 2014, bonne production sous...
- le sciellour : Bonjour, fortement handicapé de la colonne vertèbrale...
- Louisette : Beau post d'explication agriculture raisonnée,beau blog ...
- White Tendance : Bonjour à vous tous
- Jenny : Chez moi c'est un ravissement car les feuilles mortes vont...
- Lobooc : Superbe fleur
- Combey : Bonjour Nous sommes une multinationale implantée en...
-
Image du jour
-
Statistiques
Chers Jovaciens et chers Amis du Blog de Jouy sous Thelle, bienvenue sur notre blog, qui fut créé le 12 novembre 2012. .Déjà 5 ans de partages et de visites. Vous êtes le 101ème visiteur depuis ce matin.
231 pages consultées ce jour .3522 internautes sur le réseau Eklablog..
4 Connecté(s) sur le Blog.
Record de connectés: 522
Le 6 juin 2015 vous êtes venus à 203 visiteurs..
Le 17 mai 2014 1675 pages ont été consultées.
Alors que 879728 pages ont été parcourues depuis le 12 novembre 2012.:
Hier ce sont 15 visiteurs qui nous ont fait le plaisir d'une visite, en portant leur intérêt sur au moins 45 Pages.
4250 articles sur le blog.
Merci pour votre Attention
Jean
-
Recherche
-
Rechercher
-
Archives
-
Newsletter
-
ChatWhite Tendance : Bonjour
White Tendance : Salut :)
toutvert : Pas mal ce nouveau site :)
boudus : Il y a des fonctions en panne sur ce blog :p
malibulu : Bravo pour ce site
conrad : Il y a un autre site comme celui-là -
Derniers visiteurs
-
Les plus commentés
- Le blason de Jouy sous Thelle (5)
- Un Cheval - Des Chevaux (5)
- Et si on changeait la date? (5)
- Régime sec dans l'Oise (5)
- Bulletin Météo du 5 novembre 2012 (4)
- Du matériel pour vos téléphones (Jeux gratuit) (4)
- Eau de pluie capturée (4)
- Coca - Aubergine - Gombos (4)
- Un Président à Beauvais (4)
- Brocante 2012 à Jouy sous Thelle (4)
-
Derniers commentaires
- Arnaud : Ca peut arriver à n'importe quelle boîte. Cette firme...
- mimine : Brocante sympa jaime
- mimine : Pas chaud
- Achille : Cultivé cette variété en 2014, bonne production sous...
- le sciellour : Bonjour, fortement handicapé de la colonne vertèbrale...
- Louisette : Beau post d'explication agriculture raisonnée,beau blog ...
- White Tendance : Bonjour à vous tous
- Jenny : Chez moi c'est un ravissement car les feuilles mortes vont...
- Lobooc : Superbe fleur
- Combey : Bonjour Nous sommes une multinationale implantée en...
-
Derniers articles
- Aeroflot
- A l'Aube Du Poète
- La page du jour de Jules Hostouley - 06/04/2020
- La page du jour de Jules Hostouley - 28/03/2020
- La page du jour de Jules Hostouley - 12/08/2017
- La page du jour de Jules Hostouley - 10/08/2017
- La page du jour de Jules Hostouley - 09/08/2017
- C'est l'heure de l'Ami Jardinier
- Elfe 2016
- Rosier jaune
-
Tableau de bord
-
Recherche